Resumão de Química #PARTIUENEM
- Uyara

- 18 de nov. de 2022
- 6 min de leitura
Atualizado: 19 de nov. de 2022
Estudo da Matéria
Matéria é tudo aquilo que tem massa e volume. É composta por moléculas e átomos unidos e ordenados de diferentes formas, o que garante diferentes propriedades específicas. Também há as propriedades gerais, que são aquelas que se aplicam a todo tipo de matéria. Matéria e energia são conceitos complementares. A energia, além de unir as partículas formadoras da matéria, está proporcionalmente relacionada a esta. Einstein descreveu matematicamente que matéria e energia são diretamente proporcionais (E=m.c²).

Estrutura Atômica
A estrutura do átomo é composta por três partículas fundamentais: prótons (com carga positiva), nêutrons (partículas neutras) e elétrons (com carga negativa). Toda matéria é formada de átomos sendo que cada elemento químico possui átomos diferentes.

Prótons
O próton é uma partícula fundamental na estrutura atômica, que apresenta carga positiva (+1). Juntamente com os nêutrons, forma todos os núcleos atômicos, exceto para o hidrogênio, onde o núcleo é formado de um único próton.
O que caracteriza um elemento é o número de prótons do átomo, conhecido como número atômico do elemento. É representado pela letra (Z).
O número de massa, representado pela letra (A), de um átomo é a soma das massas dos prótons e nêutrons. Como a massa do elétron é muito pequena (tem cerca de 1/1836 da massa do próton), ela não é considerada. O número da massa (A) do átomo é formado pela soma do número atômico (Z) com o número de nêutrons (N), ou seja, A = Z + N.
Nêutrons
O nêutron são partículas neutras que fazem parte do núcleo na estrutura atômica dos átomos, juntamente com os prótons. Ele tem massa, mas não tem carga. A massa é muito parecida com a do próton, cerca de 1,67 x 10-24 g.
Elétrons
O elétron é uma partícula subatômica que circunda o núcleo atômico, com carga negativa (-1). Os elétrons dos átomos giram em órbitas específicas e de níveis energéticos bem definidos. Sempre que um elétron muda de órbita, um pacote de energia é emitido ou absorvido.
Tabela Periódica
A tabela periódica é um modelo criado para o organizar e agrupar todos os elementos químicos já descobertos pelo ser humano. Nela, os elementos são colocados em ordem crescente de número atômico. Cada quadrado que compõe a tabela especifica o nome de um elemento químico, seu símbolo e seu número atômico.
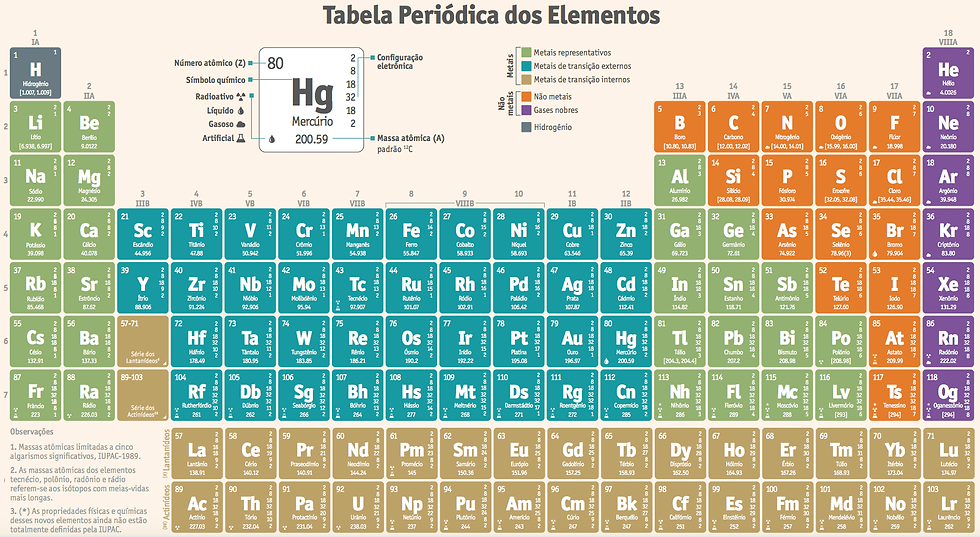
Atualmente, a tabela periódica é organizada em 7 linhas horizontais (períodos) e 18 linhas verticais (grupos ou famílias), mas nem sempre foi assim. Até chegarmos a esse modelo, ela sofreu diversas transformações e contribuições de vários cientistas.
Cada elemento químico da tabela periódica é identificado por um número atômico, que corresponde ao número de prótons (carga positiva) do átono do elemento. Quando o átomo estiver em seu estado fundamental, o número de elétrons (carga negativa) sempre será igual ao número de prótons.

A tabela periódica possui várias classificações, uma delas é quanto a natureza física dos elementos químicos.
Metais: representam a maior parte dos elementos químicos da tabela periódica e possuem características como boa condução de energia e calor; brilho metálico; solidez em condições ambientais, exceto o Mercúrio(Hg) e; maleabilidade. Pertencem a categorias dos metais: prata (Ag), ouro (Au), ferro (Fe), cobre (Cu), sódio (Na) e zinco (Zn);
Não metais ou ametais: Os ametais possuem características opostas ao metais como estado físico variável (podem ser sólidos, gasosos ou líquidos); má condutividade de energia e calor e; inflexibilidade. São exemplos de ametais: carbono (C), fósforo (P), oxigênio (O), bromo (Br), enxofre (S), flúor (F), iodo (I), nitrogênio (N) e astato (At);
Semimentais ou metaloides: esses elementos possuem características mistas dos metais e ametais como condutibilidade elétrica mediana, brilho metálico moderado, alta temperatura de fusão e possibilidade de fragmentação. São semimetais: Arsênio (As), boro (B), germânio (Ge), antimônio (Sb) e telúrio (Te);
Gases Nobres: chamados de sangue azul, os gases nobres, possuem apenas uma condição física, gás, e são e encontrados de forma isolada na natureza. São exemplos: criptônio (Kr), hélio (He), neônio (Ne), argônio (Uuo) e xenônio (Xe);
Hidrogênio: Diferente dos demais elemento da tabela periódica, o hidrogênio não se enquadra em nenhuma das categorias e são altamente inflamáveis e insolúveis em água.
Ao organizar a tabela periódica em ordem crescente de número atômico, Moseley estruturou os elementos químicos formando colunas horizontais (períodos) e verticais (famílias ou grupos).
Período - as 7 linhas horizontais da tabela periódica indicam a quantidade de camadas eletrônicas que os átomos de um elemento possui. Podem existir infinitas camadas eletrônicas, mas na prática foi identificado que os elétrons ocupam 7 camadas, nomeadas pelas letras K, L, M, N, O, P e Q.
1º período: 2 elementos; 2º período: 8 elementos;
3º período: 8 elementos;
4º período: 18 elementos;
5º período: 18 elementos;
6º período: 32 elementos;
7º período: 32 elementos.
Por exemplo, o boro (B) está no segundo período e possui duas camadas eletrônicas, já potássio (K) e ferro (Fe) estão no quarto período e possuem quatro níveis eletrônicos (K, L, M, N) e assim vai.
Termoquímica
Termoquímica é a parte da química que estuda a quantidade de calor (energia) envolvida nas reações químicas. Quando uma reação libera calor, ela é classificada como exotérmica. A absorção de calor em uma reação, faz com que ela seja endotérmica.
Nas reações químicas pode haver absorção ou liberação de energia. Essa transferência de calor é feita a partir do corpo que tem a temperatura mais alta para aquele que possui a temperatura mais baixa.
Vale lembrar que o calor, também chamado de energia calorífica, é um conceito que determina a troca de energia térmica entre dois corpos. O equilíbrio térmico é estabelecido quando os dois materiais atingem a mesma temperatura.
Chama-se reação endotérmica a reação em que há absorção de calor. Dessa forma, um corpo absorve calor do meio em que ele está inserido. É por isso que a reação endotérmica provoca uma sensação de resfriamento.
Já a reação exotérmica é o inverso. Trata-se da liberação de calor e, assim, a sensação é de aquecimento.

Entalpia (H) é a energia trocada nas reações de absorção e de liberação de energia, respectivamente, endotérmica e exotérmica. Não existe um aparelho que seja capaz de medir a entalpia. Por esse motivo, mede-se a sua variação (ΔH), o que é feito considerando a entalpia do reagente (energia inicial) e a entalpia do produto (energia final).
A variação de entalpia (ΔH) em uma reação química depende apenas dos estados inicial e final da reação, independente do número de reações.
Cinética química e Equilíbrios químicos
Cinética química é o ramo da química que estuda a rapidez das reações químicas, bem como os fatores que a influenciam. A rapidez, ou velocidade, de uma reação química indica a variação da quantidade de reagentes e produtos com o passar do tempo.
O equilíbrio químico é um fenômeno que acontece nas reações químicas reversíveis entre reagentes e produtos. Quando uma reação é direta, está transformando reagentes em produtos. Já quando ela ocorre de maneira inversa, os produtos estão transformando-se em reagentes.
Elas podem ser rápidas, moderadas ou lentas:
Reações rápidas ocorrem instantaneamente, com duração de microssegundos. Um exemplo é a queima do gás de cozinha.
Reações moderadas levam de minutos a horas para serem finalizadas.
Reações lentas podem durar séculos, porque os reagentes combinam-se lentamente.


Equilíbrio iônico é todo equilíbrio químico que envolve a participação de íons.” A dissociação de íons em determinada substância dificilmente será total. Um ácido é considerado forte, por exemplo, quando ele, em solução aquosa, é capaz de dissociar uma grande quantidade de íons.
O deslocamento em equilíbrios iônicos ocorre quando é adicionado ao meio reacional um íon comum ou íon que reage com um de seus componentes. O deslocamento em equilíbrios iônicos segue o princípio de Le Chatelier da mesma forma que um equilíbrio envolvendo um processo químico sem íons.
O efeito do íon comum ocorre quando nós temos uma reação reversível que já está em equilíbrio e, então, adicionamos um íon comum, isto é, já existente na reação. Com essa adição, poderão ocorrer algumas alterações no equilíbrio, como o seu deslocamento.
As fórmulas das ligações iônicas são a fórmula unitária (que indica a proporção dos íons no aglomerado iônico) e a fórmula de Lewis, que mostra os elétrons de valência. A ligação iônica ocorre entre íons, conforme o próprio nome sugere.
Eletroquímica
A Eletroquímica é um ramo da Química que estuda o fenômeno da transferência de elétrons para a transformação de energia química em energia elétrica e vice-versa. As reações que envolvem transferência de elétrons são chamadas de reações de oxirredução, pois nelas ocorrem simultaneamente a redução e a oxidação.


Química Ambiental
A Química Ambiental estuda todo e qualquer processo químico que ocorra na natureza. Entende-se como Química ambiental o campo de estudos que tem por objetivo conhecer todos os processos químicos que ocorrem na natureza, seja de forma natural, seja provocado por alguma interferência humana. E exerce um papel extremamente importante, já que estuda os processos químicos que ocorrem no meio ambiente, ajudando a preservá-lo e conservá-lo.
- Aquecimento global
- Buraco na camada de ozônio
- Chuva ácida
- Smog fotoquímico









Comentários